Pengertian
Tujuan dari pelaksanaan Validasi Pembersihan (Cleaning Validation) adalah untuk MEMBUKTIKAN bahwa prosedur yang ditetapkan untuk membersihkan suatu peralatan pengolahan, hingga pengemasan primer mampu membersihkan sisa bahan aktif obat dan deterjen yang digunakan untuk proses pencucian dan juga dapat mengendalikan cemaran mikroba pada tingkat yang dapat diterima.
Tujuan lain :
- Peralatan/mesin yang dibersihkan tidak terdapat pengaruh yang negatif karena efek pembersihan.
- Operator/pelaksana yang melakukan pembersihan kompeten, mengikuti prosedur pembersihan dan peralatan pembersihan yang telah ditentukan.
Mengapa Prosedur Pembersihan harus divalidasi ?
- Biasanya, peralatan yang digunakan untuk produksi, dipakai untuk berbagai macam produk, sehingga sangat berisiko terjadi kontaminasi silang (cross contamination)
- Dengan semakin canggihnya mesin dan tekhnologi pengolahan atau pengemasan, semakin menambah luasnya area kontak antara bahan obat dengan permukaan mesin.
- Semakin meningkatnya tuntutan c-GMP.
Prinsip dan Ruang Lingkup
Tersedianya prosedur pembersihan yang efektif untuk membersihkan peralatan pengolahan hingga pengemasan primer adalah penting untuk mencegah risiko kontaminasi silang terhadap produk berikutnya yang diproduksi di peralatan yang sama.
Kontaminasi dapat bersumber dari:
- bahan aktif obat dari produk sebelumnya
- bahan pembersih / deterjen
- mikroba dari lingkungan
- bahan lain (debu, pelumas)
Pembersihan dilakukan setelah pembuatan ataupun pengemasan suatu produk. Hasil pembersihan efektif akan menghilangkan sisa cemaran bahan aktif obat sisa deterjen maupun tingkat cemaran mikroba bila mengikuti prosedur yang telah divalidasi. Setelah zat penanda (marker) ditetapkan sesuai tingkat kelarutan maupun toksisitasnya, maka prosedur penetapan kadar residu disiapkan dan divalidasi.
Pengamatan dan pengujian dilakukan terhadap:
- Pengamatan secara visual kebersihan permukaan alat yang kontak langsung dengan produk
- Kualitas air bilasan akhir
- Residu yang diambil secara usap dan / atau bilas
- Cemaran mikroba pada permukaan alat yang kontak dengan produk.
Beberapa hal yang perlu diperhatikan dalam pelaksanaan Validasi Pembersihan :
- Penentuan batas kandungan residu suatu produk, bahan pembersih dan pencemaran mikroba, secara rasional hendaklah didasarkan pada bahan yang terkait dengan proses pembersihan. Batas tersebut hendaklah dapat dicapai dan diverifikasi
- Harus tersedia METODE ANALISA TERVALIDASI yang memiliki kepekaan untuk mendeteksi residu atau cemaran. Batas deteksi masing-masing metode analisis hendaklah cukup peka untuk mendeteksi tingkat residu atau cemaran yang dapat diterima.
- Hendaklah dipertimbangkan juga untuk bagian alat yang tidak bersentuhan langsung dengan produk.
- Interval waktu antara penggunaan alat dan pembersihan hendaklah divalidasi demikian juga antara pembersihan dan penggunaan kembali. Hendaklah ditentukan metode dan interval pembersihan
- Untuk mesin yang sama (merek, jenis/type) hanya salah satu yang harus divalidasi. Jika dalam proses menggunakan rangkaian mesin yang berbeda secara berkelanjutan (in line machine), masing-masing mesin harus tetap divalidasi secara terpisah. Jika rangkaian mesin merupakan kombinasi mesin yang permanen, validasi bisa dilaksanakan bersama-sama.
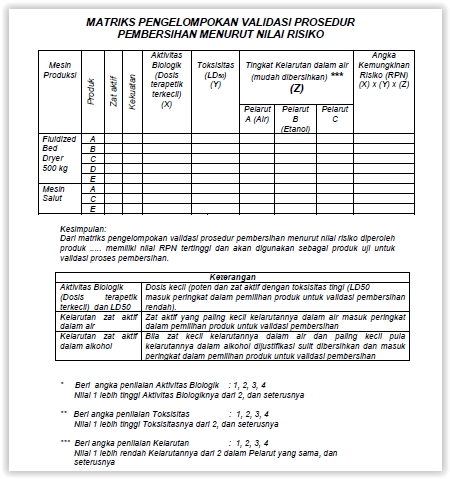
Penetapan “Senyawa Marker” (active substance) yang divalidasi
Salah satu perubahan penting dalam CPOB 2012 adalah dimasukkannya (incorporasi) Manajemen Risiko Mutu (Quality Risk Management/QRM), termasuk dalam pelaksanaan Validasi Pembersihan. Dalam menentukan “senyawa marker” yang digunakan untuk pelaksanaan validasi pembersihan, harus dilakukan KAJIAN terhadap active substance yang digunakan berdasarkan NILAI RISIKO-nya.
Contoh :
Kita akan melaksanakan Validasi Pembersihan terhadap Protap Pembersihan Mesin Fluid Bed Dryer (FBD) yang digunakan untuk mengeringkan granul dan film coating. Mesin ini digunakan untuk proses pengeringan produk A, B, C, D, dan E; serta proses film coating untuk produk A, C, dan E. Maka, langkah pertama yang harus kita lakukan adalah MEMILIH produk mana yang akan kita gunakan sebagai “marker” untuk menilai efektifitas prosedur pembersihan mesin FBD yang sudah ditetapkan. Untuk menentukan senyawa marker tersebut digunakan Kajian Risiko, sebagai berikut :
Metode Pengampilan Sampel (Cuplikan)
- Metode Apus (swab sampling method)
- Prinsip: Residu diperoleh dengan mengapus (swab) langsung pada permukaan alat/ruangan yang kontak dengan produk. Hasil swab dianalisis untuk kandungan residu setelah melalui proses ekstraksi atau untuk kandungan mikro-organisme setelah melalui kultur mikroba dan inkubasi.
- Merupakan metode pengambilan sampel dengan cara menggunakan bahan apus (swab material) yang dibasahi dengan pelarut yang langsung dapat menyerap residu dari permukaan alat.
- Bahan yang digunakan untuk sampling harus kompatibel dengan solvent dan metode analisanya.
- Tidak ada sisa-sisa serat yang mengganggu analisa.
- Ukuran material harus disesuaikan dengan area sampling
Sedangkan bahan pelarut (solvent), harus :
- Disesuaikan dengan spesifikasi bahan yang diperiksa.
- Tidak mempengaruhi stabilitas bahan yang diuji.
- Sebelum dilakukan validasi, harus dilakukan pemeriksaan/ uji perolehan kembali (recovery test) dengan larutan yang diketahui kadarnya.
Kelebihan/kekurangan
Kelebihan :
- Contoh yang sudah mengering atau sulit larut dapat ”dilepaskan” dari permukaan secara fisik.
- Lokasi yang sulit dibersihkan dapat dicapai dengan swab sehingga memungkinkan evaluasi paling langsung terhadap tingkat kontaminasi atau jumlah residu setiap (permukaaan)
Kekurangan :
- Adanya variasi hasil yang disebabkan oleh pemilihan lokasi, tekanan (physical force) yang digunakan dan totalitas permukaan yang di-swab.
- Pelarut swab dapat mempengaruhi residu.
- Proses analisis ekstraksi dapat mempengaruhi/mengurangi recovery rate (perolehan kembali).
- Sampel yang terbatas dapat mempengaruhi sensitivitas hasil analisis.
Metode pengambilan sampel dan pengujian:
- Bersihkan kapas usap dengan merendam dalam methanol / pelarut sesuai validasi metode selama 5 menit, sonifikasi dan peras.
- Pada saat pengambilan sampel, basahkan kapas usap dalam metanol/pelarut sesuai validasi, peras kelebihan pelarut dengan menekan di bibir bagian dalam wadah.
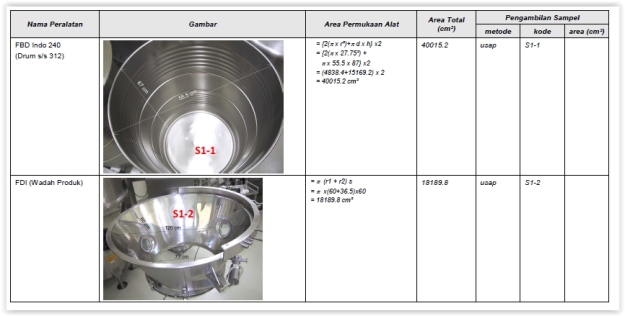
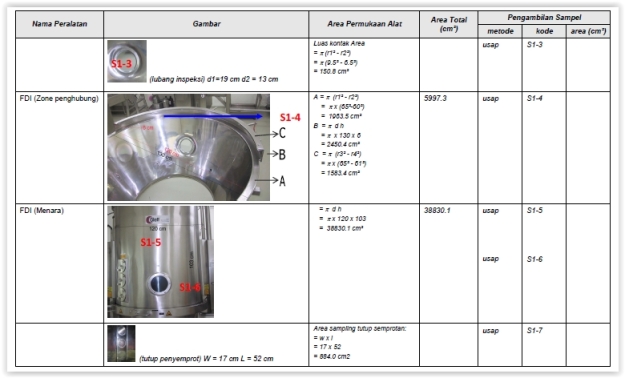
- Sampel diambil di area kritis sesuai protokol.
- Letakkan bingkai SS 5 x 5 cm di area yang akan diusap.
- Usap luas area yang ditentukan sesuai arah berikut:
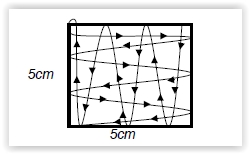
- Masukkan kembali kapas usap ke dalam tabung bersih, tutup.
- Sampel di uji dengan metode analisis yang telah divalidasi.
Contoh Pengambilan sambel dengan cara apus :
- Metode Pembilasan Terakhir (Rinse sampling method)
- Prinsip: Residu diperoleh dengan mengumpulkan pelarut pembilas yang telah kontak dengan permukaan alat dimana produk diproses. Hasil bilas kemudian dianalisis untuk kandungan residu dan atau kandungan mikroba.
- Umumnya dilakukan untuk alat/mesin yang sulit dijangkau dengan cara apus (banyak pipa, lekukan, dan lain-lain).
- Pelarut pembilas harus tidak boleh menyebabkan penguraian/degradasi residu.
- Pelarut pembilas harus kontak dengan permukaan alat dalam waktu yang cukup agar residu dapat larut sempurna.
Kelebihan/kekurangan
Kelebihan :
- Pengambilan contoh dimungkinkan terhadap permukaaan yang luas.
- Keseluruhan lokasi dipermukaan dapat dicapai tanpa kesulitan sehingga memungkinkan evaluasi dengan tingkat recovery rate yang tinggi .
- Variasi hasil analisis lebih kecil dibanding dengan cara apus.
- Jika dilakukan dengan benar, hasil pemeriksaan dapat mencerminkan kondisi seluruh permukaan alat.
Kekurangan :
- Tidak cocok untuk peralatan kompleks bermuatan instrumen atau komponen listrik/elektronik. Misalnya mesin tablet, FBD, Granulator, mesin pengisi serbuk, dan lain-lain.
Metode pengambilan sampel dan pengujian:
- Kumpulkan 500 ml air bilasan terakhir dan 500 ml secara aseptis untuk uji cemaran mikroba.
- Ambil juga sampel Air Murni yang digunakan untuk membilas sebagai pembanding.
- Air bilasan diuji terhadap parameter pH, konduktivitas, logam berat, nitrat, TOC, cemaran mikroba dan dibandingkan dengan kualitas air murni yang digunakan dalam pembilasan.
- Metode dengan menggunakan placebo
- Prinsip: Residu diperoleh dari batch produk plasebo yang dibuat dengan cara simulasi dala kondisi yang sebenarnya. Contoh produk sepanjang proses produksi melalui suatu rangkaian alat kemudian dianalisis untuk kandungan residu atau kandungan mikro-organisme.
- Pengambilan sampel yang dilakukan dengan cara pengolahan produk yang bersangkutan tanpa bahan aktif dengan peralatan yang sudah dibersihkan kemudian dianalisa.
Kelebihan/kekurangan
Kelebihan :
- Contoh yang diambil merupakan simulasi proses produksi yang sebenarnya .
- Memberi kemungkinan penilaian langsung terhadap efek kumulasi tahapan proses produksi karena pendekatan validasi dilakukan pada suatu rangkaian peralatan.
Kekurangan :
- Tingkat sensitivitas dari recovery rate (perolehan kembali) residu terlalu rendah karena faktor pengenceran selama proses produksi.
- Metode ini tidak disarankan, karena tidak reproducible.
Penetapan Kadar Cemaran Bahan Aktif Obat (BAO)
Dalam rangka mengevaluasi prosedur pembersihan, penting untuk menetapkan tingkat cemaran bahan aktif obat yang dapat diterima Total cemaran pada peralatan dapat dihitung berdasarkan hasil usap atau bilas yang mewakili seluruh permukaan.
Pendekatan skenario terburuk:
Perhitungan cemaran dilakukan secara terpisah untuk setiap alat yang dipakai dalam proses pengolahan produk hingga pengemasan primer. Tingkat cemaran bahan aktif obat dihitung berdasarkan luas permukaan alat yang kontak dengan produk dan ukuran bets terkecil yang pada proses berikutnya setelah proses pembersihan alat.
Penetapan cemaran mikroba
- Efektifitas prosedur pembersihan untuk mengendalikan tingkat cemaran mikroba dengan menguji kebersihan permukaan setelah proses pembersihan alat dan pembilasan akhir.
- Cemaran mikroba diperiksa setelah proses pencucian maupun pada akhir
penetapan lamanya status “bersih”. - Sampel untuk pengujian cemaran mikroba diambil dengan cara usap, rodac plates ataupun dari air bilasan akhir.
Kriteria Keberterimaan
- Kriteria keberterimaan ditetapkan secara rasional berdasarkan risiko terbawanya sisa bahan aktif obat ke produk lain berikutnya serta risiko cemaran mikroba.
- Kebersihan secara visual
Kriteria: tidak tampak sisa pengotor di permukaan peralatan setelah pembersihan yang mungkin mencemari produk berikutnya. - Tingkat cemaran bahan aktif obat
Bila lebih dari satu produk diproses dengan peralatan yang sama, Batas ditetapkan sebagai Maximum Allowable Carryover (MACO) untuk penetapan residu bahan aktif obat. - Penetapan Batas Cemaran
Batas paling ketat diambil berdasarkan ketentuan:
- Kebersihan secara visual
- Dosis terapetik harian
Bila dosis perhari dari produk yang dibuat berikutnya dan produk yang dibuat sebelum pencucian alat diketahui, maka perhitungan MACO diperhitungkan sebagai bagian dari Minimum Single Dose (MSD) dari produk (X) yang akan dihilangkan dalam Maximum Daily Dose (MDD) dari produk berikutnya (Y): 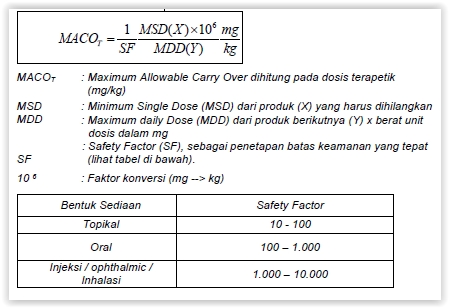
- Data toksisitas
Catatan Umum: menghasilkan angka carry over yang sangat tinggi dan tidak dapat diterima, MACO dibatasi pada 1000 mg/kg.
Data toksisitas dapat digunakan untuk menghitung MACO jika dosis terapetik tidak tersedia (misal untuk bahan antara atau prekursor). Dihitung dengan persamaan berikut: 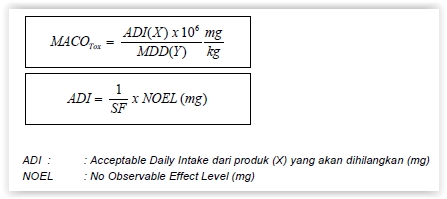
- Batas Umum 10 ppm
Secara umum, tidak lebih dari 10 mg/kg (= 10 ppm) zat penanda (marker) yang harus dibersihkan dari produk sebelumnya - Batas visual
Batas visual ditetapkan 100 μg/ 25 cm2. - Deterjen
Gunakan deterjen dengan komposisi yang diketahui. Bila tidak diketahui, deterjen food grade dipilih yang diketahui tingkat toksisitasnya.
Batas residu deterjen adalah sebagai berikut:
- Jika LD50 dari deterjen diketahui dan maximum daily dose dari produk berikutnya tersedia, MACO dapat dihitung dengan perhitungan NOEL dan ADI seperti penjelasan pada butir 2 di atas (data toksisitas).
- Jika tidak ada data untuk maximum daily dose dari produk berikutnya, MACO dari deterjen food grade dibatasi menjadi 10 mg/kg (produksi produk jadi dan API tanpa tahap pemurnian selanjutnya) atau 100 mg/kg (produksi API).
- Batas residu untuk deterjen dapat juga ditetapkan dengan cara TOC.
- Batas Cemaran Mikroba (MAML : Maximum Allowable Microbial Limits)
Batas Cemaran Mikroba dihitung dengan mengacu pada ukuran Contoh seluas 25 cm². Batas berikut dipakai sebagai acuan: 
LAPORAN VALIDASI PROSEDUR PEMBERSIHAN
Laporan Validasi memuat:
- Hasil pengujian yang dilaksanakan sesuai protokol.
- Evaluasi dan perbandingan terhadap hasil uji yang diharapkan dari kriteria keberterimaan.
- Evaluasi terhadap adanya penyimpangan dari protokol serta tindakan koreksi yang diambil.
- Dafter referensi bila diperlukan.
- Laporan dievaluasi dan disetujui oleh Manajer Produksi, Teknik dan Pemastian Mutu.
Prinsip Utama dari Cleaning validation :
“HOW CLEAN IS CLEAN”
Demikian, mudah-mudahan bermanfaat.
Salam hangat,
BP – 22.09.2014


Batas penentuan residu terdapat 2 macam . Spesifik (penngukuran dengan HPLC) atau non spesifik (konduktivitas, TOC) . Penentuan dan pengukuran kadar residu zat aktif yang biasa dilakukan adalah dengan HPLC. Kekurangan dengan HPLC adalah relatif lama, terlalu spesifik dan tidak mengukur residu keseluruhan. Metode yang jarang dipakai tetapi sebenarnya lebih teliti adalah menggunakan pengukuran TOC analyzer. Metode ini belum diterima secara umum tetapi sudah banyak literatur yang menggunakan metode ini. Kelebihan menggunakan TOC adalah cepat (<15 menit/sampel), dapat mengukur sampai kadar 100 ppb dan dapat mengukur seluruh cemaran (representasi cemaran adalah Carbon). Akan tetapi kelemahannya adalah tidak spesifik.
Salam hangat
Terima kasih
saya mau bertanya jika dengan metode TOC,bagaimana untuk sampel yg insoluble in water,kan harus dilarutkan dengan NaOH dl, tapi setelah pembacaan hasil yg begitu variatif dan tidk memenuhi syarat, bagaimana caranya untuk analisa sampel insoluble jk dianalisis menggunakan TOC??
mohon bantuannya
Selamat Siang Pak Bambang,
Terimakasih untuk sharingngnya. Pak Bambang boleh diperjelas lagi tentang penentuan Batas Cemaran Mikroba (MAML) untuk Cawan Kontak atau Cawan Usap.
Terimakasih,
Pak Bambang saya mau tanya ,apakah kualitas dari air bilasan untuk peralatan sudah cukup membuktikan bahwa peralatan bersih dari bahan pembersih
pak bambang saya mau tanya jika hasil TOC tidak memenuhi syarat faktor apa saja yang mempengaruhinya, dan bagai mana cara penangananya
pa..mu tanya apakah teepol itu masih boleh digunakan sebagai detergent di industri farmasi?
Dear pak Bambang, saya mau bertanya, untuk persyaratan mikroba dan endotoksin untuk mesin steril dapat dilihat dimana ya? Thanks
kapan waktu yang tepat untuk sampling peralatan yang digunakan pada produk steril ?
setelah alat disterilkan atau sebelum alat disterilkan? saat melakukan cleaning validasi.
Selamat siang, Pak Pri. Maaf bila di luar konteks. Saya tertarik dengan pernyataan “deterjen food grade” Saya ingin tahu persyaratan suatu deterjen tergolong “food grade”
selamat siang pak,, mau tanya gimana untuk alat yang tipenya sama.. hanya saja bedanya ada yang menggunakan sistem manual dan yg satunya sudah sistem digital,, tpi rangkaian alatnya sama.. apa prosedur validasi pembersihannya bisa disamakan? Terimakasih
Selamat siang Pak, saya mau bertanya bagaimana caranya kita menganalisa kadar residu detergen memakai TOC sedangkan setelah part mesin dibilas menggunakan air PAM dan PW, detergen tersebut sudah hilang, dan apakah jika telah diketahui konsentrasi dari detergen yang digunakan tersebut, apakah kadar dari residu detergen bisa distandarkan ? …
Mohon bantuannya.. Terima kasih
selamat pagi pak saya inin bertanya batas visual yang 100mikrogram/ cm2 itu penetapannya dari mana ya pa, dan yang di maksud batas visual itu seperti apa ya pa? mohon dijawab pak terimakasih sebelumnya
mohon diberikan daftar pustakanya
Dear all friends, terima kasih banyak atas atensi dan pertanyaan-pertanyaannya. Sebelumnya saya mohon maaf yang sebesar-besarnya karena tidak sempat membalas atau menjawab pertanyaan teman-teman semua karena kesibukan pekerjaan saya sehari-hari.
Semoga tulisan dalam blog ini bisa membantu teman-teman semua. Selanjutnya untuk lebih detail, silahkan merujuk pada pustaka yang saya gunakan yaitu POPP CPOB yang bisa anda download di laman lain dari blog ini.
Terima kasih dan salam hangat